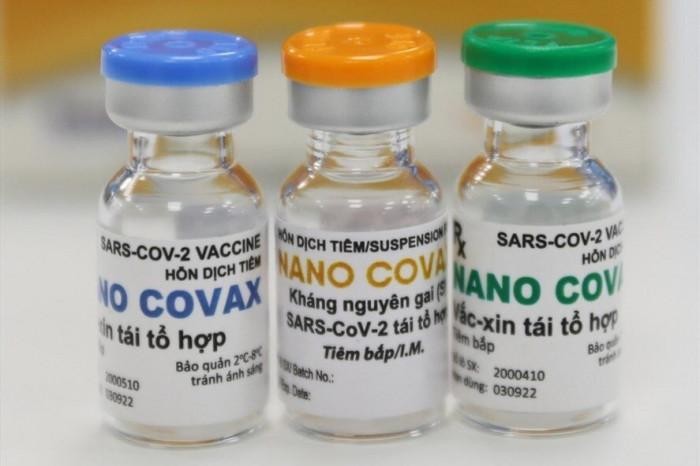
Việt Nam đang cân nhắc xem xét tiến tới cấp phép khẩn cấp cho vắc-xin Nano Covax.
Ngày 4/8, Bộ Y tế phối hợp Tổ chức Y tế thế giới tổ chức Hội thảo trực tuyến tham vấn chuyên gia về thẩm định dữ liệu nghiên cứu lâm sàng và phê duyệt vắc-xin Covid-19 trong trường hợp khẩn cấp.
Đây là phiên họp đầu tiên do hai cơ quan tổ chức, với sự tham gia của Bộ An toàn thực phẩm và dược phẩm Hàn Quốc (MFDS), các chuyên gia trong và ngoài nước nhằm hỗ trợ Việt Nam xây dựng kế hoạch thử nghiệm lâm sàng giai đoạn 3 vắc-xin Covid-19 do Việt Nam sản xuất.
Tại điểm cầu trực tuyến, GS.TS Trần Văn Thuấn, Thứ trưởng Bộ Y tế, Tổ trưởng Tổ Công tác đặc biệt về nghiên cứu thử nghiệm lâm sàng, phát triển vắc-xin phòng Covid-19, đã thông tin về tình hình chung về dịch bệnh Covid-19 tại Việt Nam.
Thứ trưởng cũng nhấn mạnh chiến lược vắc-xin là mấu chốt, đóng vai trò quan trọng trong công cuộc phòng chống dịch Covid-19.
Việt Nam đang có 2 ứng viên vắc-xin đang thử nghiệm lâm sàng giai đoạn 2-3 và Việt Nam đang cân nhắc xem xét tiến tới cấp phép khẩn cấp cho vắc-xin Nano Covax, tuy nhiên, Việt Nam hiện chưa có nhiều kinh nghiệm trong vấn đề này.
Do đó, Thứ trưởng bày tỏ mong muốn thu nhận nhiều kinh nghiệm từ các chuyên gia của WHO, MFDS Hàn Quốc và các chuyên gia trong lĩnh vực nghiên cứu, thử nghiệm lâm sàng vắc-xin, đặc biệt là vấn đề cấp phép vắc-xin trong tình trạng khẩn cấp.
Trình bày tham luận tại Hội thảo, TS Nguyễn Ngô Quang, Phó Cục trưởng Cục Khoa học, Công nghệ và Đào tạo (Bộ Y tế) cho biết, hiện nay, hai ứng viên vắc-xin trong nước gồm Nano Covax và Covivac đang trong giai đoạn thử nghiệm lâm sàng thứ 2 và thứ 3.
Cụ thể, vắc-xin Nano Covax của Công ty cổ phần Công nghệ sinh học dược Nanogen và Học viện Quân y nghiên cứu đang thử nghiệm lâm sàng giai đoạn 3, đang thực hiện đánh giá 3 yếu tố: tính an toàn, tính sinh miễn dịch, hiệu lực bảo vệ trên người Việt Nam tình nguyện từ 18 tuổi.
Trong đó, giai đoạn 3a tiến hành tiêm cho 1.000 đối tượng, đánh giá giữa kỳ tính an toàn, tính sinh miễn dịch, tỷ lệ tiêm cho nhóm tình nguyện viên vắc-xin trên nhóm tiêm giả dược là 6:1. Giai đoạn 3b được tiến hành trên 12.000 đối tượng, tỷ lệ tiêm cho nhóm tình nguyện viên vắc-xin trên nhóm tiêm giả dược là 2:1.
Dự kiến, ngày 7/8 sẽ đánh giá tổng thể kết quả cuối cùng của giai đoạn 2 và trước ngày 15/8 sẽ có đánh giá kết quả thử nghiệm lâm sàng giai đoạn 3a. Trên cơ sở này, các cơ quan liên quan sẽ rà soát để có dữ liệu ban đầu về tính sinh miễn dịch và hiệu lực bảo vệ của vắc-xin của giai đoạn 3a.
TS. Quang nhấn mạnh, Nano Covax là một trong những vắc-xin được tạo điều kiện để triển khai nghiên cứu, phát triển nhanh chóng trong thời gian qua.
Với vắc-xin Covivac do Viện vắc xin và sinh phẩm y tế (IVAC) nghiên cứu, nhóm nghiên cứu đang đánh giá tính sinh miễn dịch của TNLS giai đoạn 1 để chuyển sang giai đoạn 2. Nhóm nghiên cứu cũng kỳ vọng cuối quý III đầu quý IV/2021 sẽ có kết quả đánh giá TNLS của giai đoạn 2 để bước sang giai đoạn 3.
Về việc chuyển giao công nghệ sản xuất vắc-xin, TS Quang cho biết hiện nay, Bộ Y tế đã phê duyệt đề cương TNLS vắc-xin ARCT-154 phòng COVID-19.
Đây là vắc-xin được sản xuất theo công nghệ mRNA do một tập đoàn của Việt Nam mua của Hoa Kỳ. Theo kế hoạch, ngày 8/8, nhóm nghiên cứu sẽ khởi động chương trình thử nghiệm lâm sàng vắc-xin này.
Ngoài ra, 2 hợp đồng chuyển giao công nghệ vắc-xin Covid-19 với Nga và Nhật Bản đã được ký kết và đang triển khai.
Đại diện WHO thông tin, hiện trên thế giới có 17 vắc-xin Covid-19 đang được sử dụng, trong đó có 7 loại được WHO cấp phép khẩn cấp.
Đồng thời, tổ chức này khuyến nghị Việt Nam cần xây dựng hướng dẫn cấp phép lưu hành, sử dụng khẩn cấp để áp dụng với vắc-xin sản xuất trong nước và nhập khẩu. Được biết, Việt Nam đang nỗ lực sớm hoàn thiện thông tư về vấn đề này.
Bên cạnh đó, WHO cũng đề nghị Việt Nam cần tiếp tục tham vấn các chuyên gia trong và ngoài nước nhằm thúc đẩy tiến trình cấp phép trong tình trạng khẩn cấp để giảm thiểu rủi ro trong quá trình phát triển vắc-xin.
Theo chia sẻ của MFDS Hàn Quốc, tại quốc gia này, có 8 vắc-xin Covid-19 đang được thử nghiệm giai đoạn 1 hoặc 2, một số ứng viên dự kiến bắt đầu thử nghiệm lâm sàng giai đoạn 3 trong 6 tháng cuối năm 2021.
Hầu hết các nhà sản xuất vắc-xin ở Hàn Quốc đang cân nhắc phát triển vắc-xin thế hệ hai, tiến hành thử nghiệm lâm sàng giai đoạn 3 (pha 3) để so sánh tính sinh miễn dịch với vắc-xin Covid-19 đã được cấp phép thay vì thử nghiệm lâm sàng đánh giá hiệu lực vắc-xin có đối chứng giả dược.
Về quy trình phê duyệt vắc-xin Covid-19 của MFDS Hàn Quốc rút ngắn tối đa thời gian từ giai đoạn phát triển tiền lâm sàng đến khi xuất xưởng vắc-xin trong đó có hình thức đánh giá cuốn chiếu hồ sơ xin cấp phép nhưng vẫn phải trải qua đầy đủ các bước.
Trong đó, giai đoạn phát triển tiền lâm sàng phải họp tham vấn với đơn vị nghiên cứu phát triển vắc-xin để giảm thiểu rủi ro trong quá trình phát triển; sau đó, nhóm nghiên cứu nộp hồ sơ xin cấp phép sản xuất thuốc mới; giảm thời gian tối đa từ khi nộp hồ sơ xin cấp phép sản xuất tới lúc nộp hồ sơ xin cấp phép sinh phẩm.
Trong thời gian này, nhà chức trách sẽ đánh giá sớm theo hình thức cuốn chiếu Hồ sơ, tham vấn các ý kiến của Tổ thẩm định tâm huyết, Hội đồng tư vấn ba vòng để đánh giá trước khi cho phép sản xuất xuất xưởng.
TS Kidong Park, Trưởng Đại diện WHO tại Việt Nam, khẳng định sau phiên họp đầu tiên này, hai bên sẽ tiếp tục có các phiên làm việc để tiếp tục hỗ trợ Việt Nam nâng cao năng lực về phát triển vắc-xin Covid-19, đẩy nhanh quá trình xây dựng các quy định hướng dẫn phê duyệt vắc-xin và phát triển, mở rộng ứng dụng vắc-xin trong nước, từ đó, nhanh chóng có vắc-xin phục vụ người dân Việt Nam và kỳ vọng đưa vắc-xin do Việt Nam sản xuất ra thế giới.