Xu hướng chính trong ngành dược
Tổ chức nghiên cứu thị trường Business Monitor International (BMI) dự báo, doanh số thị trường dược phẩm Việt Nam năm nay tiếp tục tăng trưởng 2 con số, có thể đạt 6,5 tỷ USD và mức tăng trưởng bình quân giai đoạn 2019 - 2022 là 10,6%/năm.
Trong tổng doanh số thị trường dược phẩm Việt Nam, kênh bệnh viện hiện chiếm khoảng 75%; kênh bán lẻ chiếm khoảng 25%, dành cho các nhà thuốc và quầy thuốc trên cả nước. Xu hướng chung, chi trả từ bảo hiểm y tế (BHYT) sẽ ngày càng chiếm phần lớn trong chi tiêu thuốc.
Việc bảo hiểm y tế chỉ chi trả trong kênh bệnh viện, hay các bệnh viện tư đều có nhà thuốc riêng, sẽ làm hạn chế khả năng tăng trưởng của kênh bán lẻ. Thêm vào đó, Thông tư 02/2018/TT-BYT được Bộ Y tế ban hành năm 2018 với mục đích kiểm soát nguồn gốc thuốc, hạn chế việc bán thuốc kê đơn tại các nhà thuốc đang và sẽ tác động đến doanh thu của kênh nhà thuốc. Chúng tôi cho rằng, kênh ETC (bệnh viện, phòng mạch) sẽ có mức tăng trưởng cao hơn kênh OTC (nhà thuốc) trong các năm tới.

Cùng với đó, việc thay thế thuốc ngoại bằng thuốc nội trong các cơ sở y tế là một xu hướng ngày càng rõ rệt. Trong xu hướng đó, các cơ sở sản xuất trong nước sở hữu các dây chuyền EU-GMP sẽ có ưu thế hơn hẳn so với các đối thủ. Nguyên nhân là thuốc sản xuất trên các dây chuyền EU-GMP được xếp vào nhóm đấu thầu số 2 (và nhóm 1 nếu xin được visa xuất khẩu), sẽ là lựa chọn đầu tiên để thay thế cho các loại thuốc biệt dược gốc và thuốc generic ngoại thuộc nhóm 1 và 2.
Thực tế, việc đầu tư một nhà máy tiêu chuẩn EU-GMP cần rất nhiều vốn, chuyên môn và thời gian (từ 2 - 3 năm). Do đó, lợi thế của các doanh nghiệp như Công ty cổ phần Pymepharco (PME), Công ty cổ phần Dược phẩm Imexpharm (IMP) và sắp tới là Công ty cổ phần Dược - Trang thiết bị y tế Bình Định (DBD), sẽ khá vững chắc. Đây sẽ là những doanh nghiệp đầu tiên được hưởng “trái ngọt” từ sự phát triển của thuốc nội và kênh ETC.
Nâng cao tiêu chuẩn, gia tăng vị thế
Định hướng của Chính phủ là giảm chi phí y tế thông qua đẩy mạnh phổ cập bảo hiểm xã hội và thay thế thuốc ngoại bằng thuốc nội có đủ tiêu chuẩn. Song song với đó là kiểm soát việc bán thuốc kê toa, thuốc không rõ nguồn gốc tại kênh OTC. Từ đó, kênh ETC được dự báo sẽ có tốc độ tăng trưởng cao hơn kênh OTC, trong khi thuốc biệt dược gốc hết hạn bảo hộ cũng sẽ dần được thay thế bởi thuốc generic có giá thành rẻ hơn và chức năng tương đương. Trong xu thế này, các doanh nghiệp sản xuất thuốc generic nội địa có sản phẩm đủ tiêu chuẩn thay thế thuốc ngoại và có thế mạnh tại kênh ETC như PME sẽ hưởng lợi trước tiên.
So sánh với thuốc ngoại, chi phí sản xuất tại Việt Nam rẻ hơn cho cùng một tiêu chuẩn thuốc, xuất phát từ giá nhân công, chi phí xây dựng cơ bản và vận hành nhà máy thấp hơn các quốc gia phát triển.
Thông tư 15/2019/TT-BYT của Bộ Y tế (có hiệu lực từ tháng 10/2019) có quy định về phân chia lại gói thầu và nhóm thuốc đối với thuốc generic, thay thế Thông tư 11/2016/TT-BYT (ban hành năm 2016). So sánh giữa 2 thông tư, chúng tôi nhận thấy, tiêu chuẩn kỹ thuật của các nhóm thầu được nâng cao và thuốc sản xuất trong nước được ưu tiên hơn.
Đáng chú ý, theo quy định mới, để đấu thầu vào nhóm 2, cơ sở sản xuất phải có tiêu chuẩn EU-GMP hoặc PIC/S-GMP của nước đồng thời là thành viên PIC/S và ICH - là các quốc gia phát triển, phân biệt với PIC/S tiêu chuẩn thấp hơn được cấp bởi các quốc gia khác. Cùng với đó, các tiêu chuẩn PIC/S dù được cấp bởi nước nào cũng sẽ không còn được đấu thầu vào nhóm 1 theo quy định mới. Mặt khác, để đầu tư cho một nhà máy tiêu chuẩn EU-GMP, mất từ 3 - 4 năm cho toàn bộ công đoạn chuẩn bị, xây dựng và xét duyệt. Hiện tại, ở Việt Nam chỉ có 6 cơ sở sản xuất đạt tiêu chuẩn này.
Chúng tôi nhận định, các thay đổi trên là có lợi đối với các doanh nghiệp dược nội địa có nhà máy EU-GMP, khi mức độ cạnh tranh trong nhóm thuốc số 1 và 2 được giảm bớt.
Ngoài ra, Luật Dược số 105/2016/QH13 (có hiệu lực từ 1/1/2017) quy định, không chào thầu thuốc nhập khi thuốc sản xuất trong nước đáp ứng yêu cầu về điều trị, giá thuốc và khả năng cung cấp. Tuy nhiên, từ đó đến nay, quy định này chưa tác động lên việc đấu thầu vào kênh ETC của các doanh nghiệp dược trong nước. Lý do là các cơ sở y tế vẫn cần thêm các nghị định và thông tư hướng dẫn cụ thể hơn.
Cho đến Thông tư 15 mới đây, Điều 27 có hướng dẫn về việc lập hồ sơ mời thầu. Theo đó, thuốc có tiêu chuẩn EU- GMP và WHO-GMP nằm trong danh mục thuốc sản xuất trong nước đáp ứng yêu cầu về điều trị, giá thuốc và khả năng cung cấp (kèm theo Thông tư 03/2019/TT-BYT) thì không được phép chào thầu thuốc nhập khẩu cho lần lượt các nhóm 2 và 5.
Do đó, chúng tôi kỳ vọng, quá trình chuyển dịch từ thuốc ngoại sang thuốc nội đủ tiêu chuẩn sẽ diễn ra nhanh hơn giai đoạn trước đây.
Đấu thầu thuốc 2019 - 2020: Lợi thế các nhà máy tiêu chuẩn EU-GMP
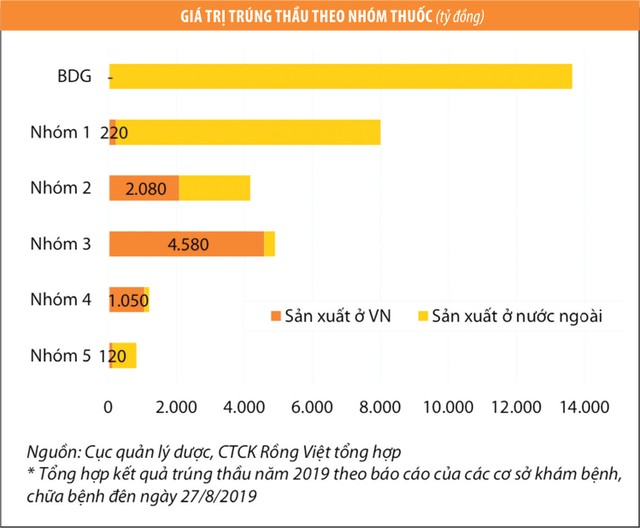
Theo kết quả đấu thầu 2019 - 2020, thuốc sản xuất tại Việt Nam chỉ đáp ứng được hơn 40% nhu cầu thuốc generic tại các cơ sở khám/chữa bệnh. Đa phần các công ty dược Việt Nam đang đấu thầu ở nhóm thuốc 3, 4, 5 là các nhóm chỉ yêu cầu tiêu chuẩn WHO-GMP. Trong khi đó, thuốc nội chiếm 3% giá trị trúng thầu thuốc nhóm 1 (tổng giá trị 8.000 tỷ đồng) và 50% giá trị trúng thầu nhóm 2 (tổng giá trị 4.170 tỷ đồng) - là 2 nhóm thuốc yêu cầu cơ sở sản xuất phải đạt tiêu chuẩn EU-GMP hoặc PIC/S-GMP.
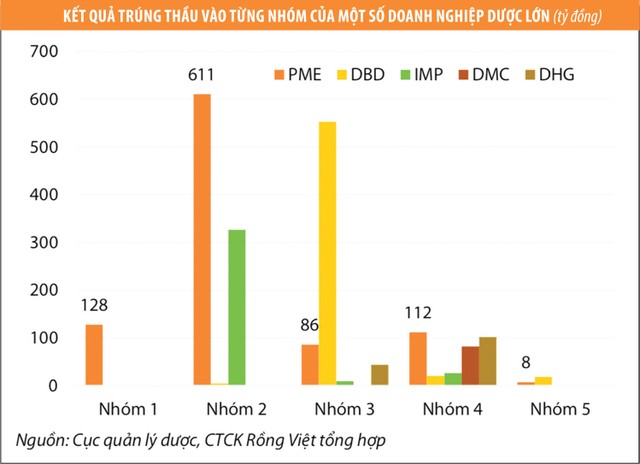
Trong số các doanh nghiệp dược niêm yết lớn, hiện chỉ có PME và IMP có nhà máy tiêu chuẩn EU-GMP, qua đó, có thể đấu thầu vào nhóm thuốc số 1 và 2. Trong đó, PME được hỗ trợ chuyển giao công nghệ và sản phẩm từ đối tác Stada (Đức) nên có lợi thế đấu thầu vào nhóm 1. Trong khi đó, DBD, với thế mạnh là thuốc điều trị ung thư, cũng đang xây dựng một nhà máy tiêu chuẩn EU-GMP, dự kiến vận hành từ quý IV/2019, nhưng việc xét tiêu chuẩn EU-GMP cần thêm thời gian.
Trong số các doanh nghiệp dược niêm yết lớn, hiện chỉ có PME và IMP có nhà máy tiêu chuẩn EU-GMP, qua đó có thể đấu thầu vào nhóm thuốc số 1 và 2. Trong đó, PME được hỗ trợ chuyển giao công nghệ và sản phẩm từ đối tác Stada (có visa xuất khẩu sang Đức) nên có lợi thế đấu thầu vào nhóm 1. Trong khi đó, DBD, với thế mạnh là thuốc điều trị ung thư, cũng đang xây dựng một nhà máy tiêu chuẩn EU-GMP, dự kiến vận hành từ quý IV/2019, nhưng việc xét tiêu chuẩn EU-GMP cần thêm thời gian.